TERMODINÂMICA
1. Conceitos Fundamentais
Termodinâmica é o estudo estatístico da natureza, a partir dela podemos estudar sistemas físicos complexos e de muitos corpos.
Sistema termodinâmico: Se constituído em regiões diferentes, ou seja, é um local que existam regiões separadas por paredes, por exemplo. EX: um balão cheio de hélio.
Estado termodinâmico: é caracterizado pelas variáveis de estado, pois estas podem definir totalmente o sistema termodinâmico.
Equilíbrio Termodinâmico: Caracterizado pela constancia espontânea das variáveis que definem o estado termodinâmico
Transformações Reversíveis: é uma transformação que ocorre de forma muito lenta, assim possibilitando voltar ao estado inicial de equilíbrio. Ex: Aquecimento ou resfriamento de uma transformação isovolumétrica.
Transformações Irreversíveis: caracterizada pelas mudanças das variáveis de estado em relação ao estado inicial de tal forma que não é possível retornar ao estado inicial Exercícios de Fixação
2.Trabalho realizado numa transformação ISOBÁRICA
Sabemos do estudo dos gases que uma transformação isobárica acontece quando o gás sofre variação em seu volume (V) ou temperatura (T) com a pressão (P) constante. Já o trabalho (τ) esta definido como uma força (F) aplicada para deslocar certo objeto em determinada distancia (d) relacionado com o cosseno do ângulo (x) entre a força aplicada e esta distancia.
Desta forma, podemos definir o trabalho de forma generalizada que se dá:
τ = F.d.cosx de forma que podemos transformar esta equação para termodinâmica, ou seja,
τ = P.∆V.cosx, mas como a força estana direção do movimento o ângulo entre esses é zero, logo o cosseno zero é igual a um, então:
τ = P.∆V ou τ = P.(V – V0), onde V é o volume final e V0 o volume inicial.
Ao determinar o trabalho de uma expansão, ou seja, o gás realiza trabalho, pois houve um aumento de volume, o resultado do trabalho é positivo (τ >0). Já ao determinar o trabalho de uma compressão, ou seja, o gás sofre uma diminuição do volume, o resultado do trabalho é negativo (τ <0 ). Agora se não houver variação de volume o trabalho será nulo consequentemente o trabalho também (τ =0).
O trabalho realizado ou sofrido pelo gás pode ser determinado a partir do gráfico PxV, ou seja, área determinada abaixo da transformação nesse gráfico é equivalente ao trabalho realizado, ou seja,
Ou seja, nesse gráfico abaixo o trabalho é equivalente a área de um quadrado, então:
Base x Altura, se considerarmos Vf = 2L e Vi = 1L e a pressão 2atm o trabalho é equivalente a fazer (2 – 1) x 2 = 2J.

Ainda se pode determinar o trabalho de uma compressão ou expansão de um gás em transformações cíclicas, onde o trabalho total é igual a soma dos trabalho de cada transformação contida nessa transformação cíclica, ou seja:
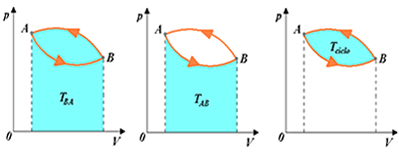
De acordo com o gráfico P x V nota-se duas transformações, uma compressão de BàA e uma expansão de A àB e no último gráfico mostra a transformação cíclica. Desta forma para determinar o trabalho desta transformação cíclica é necessário somar os trabalhos da compressão e da expansão. Como uma das leis de rege a termodinâmica quando se esta analisando transformações reversíveis é que independente da transformação o trabalho total de uma transformação cíclica é zero, pois nesse tipo de transformação não há perdas de energia.
3. LEIS DA TERMODINÂMICA
1ͣ Lei ou Principio da conservação de energia: Relaciona três grandezas termodinâmica, o trabalho (τ) de uma transformação, a quantidade de calor (Q) doado e recebido pelo sistema termodinâmico e a energia interna (∆U) desse sistema, então a definição matemática fica:
Q = τ + ∆U ainda podemos fazer ∆U = Q - τ
Aplicação da primeira Lei nas transformações:
Isobárica: como a pressão é constante o volume na transformação pode variai, assim, como já foi citado, o trabalho pode ser negativo ou positivo, logo;
∆U = Q - τ
Isotérmica: como a temperatura é constante nessa transformação, não há variação na energia interna, ou seja, ∆U = 0, então;
Q = τ
Isovolumétrica: nessa transformação o volume é constante, logo não há variação de volume e consequentemente o trabalho é zero (τ = 0), então;
∆U = Q
Adiabática: nessa transformação não há troca de calor entre o sistema termodinâmico e o meio, ou seja, a quantidade de calor é zero (Q = 0), então;
∆U = - τ ou - ∆U = τ
4. Calor específico molar de um gás (cmolar)
Definido como a quantidade de calor (Q) doado ou recebido por um conjunto de partículas (n) que compõem o gás, ou seja, um mol desse gás com a variação de temperatura (∆T), ou seja;
Cmolar = Q / n.∆T
O calor molar específico ainda pode ser com a pressão constante (cp ) ou com o volume constante (cv), logo;
Cp = Qp / n.∆T e Cv = Qv / n.∆T
2ͣ Lei: Para que possa ser enunciada esta lei é necessário antecipar a definição de máquinas térmicas, pois um dos conceitos, que são dois, esta relacionada com estes dispositivos. Então, máquina térmica é um dispositivo que operando em ciclos transforma calor em trabalho. Ex motores a combustão. Desta forma, os dois conceitos da segunda lei da termodinâmica trata de;
1 – Não existe uma máquina que operando em ciclos, ou seja, de forma periódica transforme todo calor (100%) em trabalho.
2- Para que a máquina térmica troque calor é necessário que exista uma fonte fria (Q2) e uma fonte quente (Q1), ou seja, o calor é cedido pela fonte quente e o calor que não é utilizado é desperdiçado pela fonte fria, ou seja;
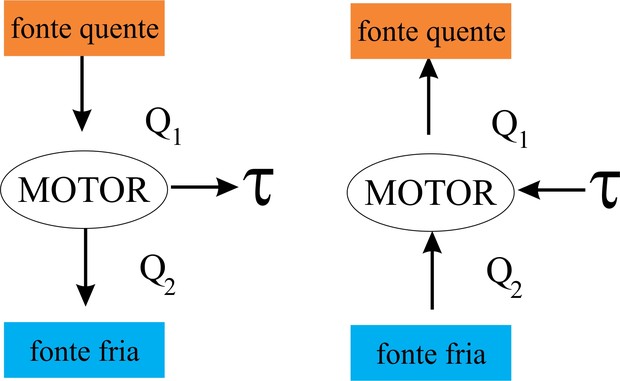
Para determinar o trabalho (τ) basta subtrair o calor cedido pela fonte menos o desperdiçado pelo fonte fria, ou seja;
τciclo = Q1 - |Q2|
Rendimento de uma máquina térmica (η): é determinado pela razão entre o trabalho realizado pelo trabalho da máquina térmica em cada ciclo e a quantidade de calor que esta consome, ou seja;
η = τ / Q1 mas τ = Q1 - |Q2| logo η = Q1 - |Q2| / Q1 ou η = 1 - |Q2| / Q1
Observação:
Existe máquina térmicas conhecidas por sua importância, uma delas é o Ciclo de Otto ou Ciclo de quatro tempos que são máquinas, no caso motores a combustão que funcionam com gasolina e etanol, a ignição é através da faísca ocasionando a explosão.
Outro ciclo é o ciclo diesel, também é de quatro tempos mais aqui o motor funciona com diesel, a ignição aqui funciona a base de compressão do combustível.
Eficiência de uma máquina térmica (e): determinada pela razão entre o trabalho realizado e o calor recebido pela fonte quente, ou seja;
e = τ /Q1
No estudo de sistemas termodinâmicos irreversíveis surge uma variável de estado muito importante chamada de entropia (∆S), esta grandeza é ligada a quantidade de energia utilizada por um sistema termodinâmico, por exemplo, o universo, e também ligada à desordem das partículas que compõem tal sistema termodinâmico. Para determinar esta grandeza basta fazer a razão entre a quantidade de calor e a temperatura que esse sistema esta, ou seja;
∆S = Q / T
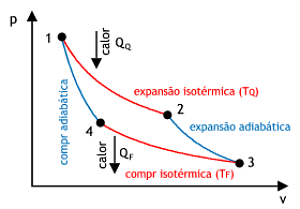
5.Ciclo de Carnot
É composto por duas transformações isotérmicas e duas transformações adiabáticas. Foi descrito e analisado pelo engenheiro francês Sadi Carnot, em 1824, em seus estudos sobre as máquinas térmicas. O ciclo de Carnot pode ser descrito pelas seguintes etapas:
- O gás sofre uma transformação isotérmica. Se expande e absorve a quantidade de calor Q1 de uma fonte quente à temperatura T1.
- Após a transformação isotérmica, o gás sofre uma transformação adiabática (sem trocas de calor com o meio). Como se expande adiabaticamente, sua temperatura cai para um valor T2.
- Em seguida, o gás sofre uma compressão isotérmica e libera uma quantidade de calor Q2 para a fonte fria à temperatura T2.
- Finalmente, retorna a condição inicial após sofrer uma compressão adiabática.
EXERCÍCIOS DE FIXAÇÃO
1) Um certo gás está confinado em um recipiente, onde a variação da energia interna é três vezes a quantidade de trabalho realizado por ele, sabendo que este gás está sob uma pressão de três atmosferas e que a variação de volume é quarenta cm3 , responda o que se pede:
- Qual a quantidade de calor recebido por este gás e qual a quantidade de trabalho realizado por este gás.
- Sabendo que o número de moles é igual a dez e que a constante do gás é igual a 8,3.1023J/mol.K, qual a variação de temperatura sofrida por este gás.
2) Duas máquinas térmicas A e B funcionam através de ciclos, sabendo-se que a quantidade de calor da fonte quente, da máquina A, é três vezes menor que o calor da fonte fria e que a máquina B tem a quantidade de calor da fonte fria maior quatro vezes que a quantidade de calor da fonte quente, responda o que se pede.
- Se o calor da fonte quente da máquina A é igual a quantidade de calor da fonte fria da máquina B que vale 2000J, qual o rendimento das duas máquinas?
- Qual a eficiência das duas máquinas?
| Para as RESOLUÇÕES dos exercícios ou DÚVIDAS envie sua resposta ou mensagem para: respostas@pontodainformacao.com |

